Wyniki dla: układ pokarmowy
W przekrojowym badaniu obserwacyjnym, którym objęto 302 osoby zakażone COVID-19, naukowcy z Madrytu i Granady przeanalizowali związek higieny jamy ustnej i tzw. codziennych nawyków stomatologicznych z transmisją zakażenia SARS-CoV-2 wśród osób/rodzin mieszkających pod jednym dachem (korzystających ze wspólnej łazienki).
SARS-CoV-2 – drogi zakażenia
Koronawirusy wykazują tropizm głównie do komórek nabłonkowych, które wyścielają drogi oddechowe i układ pokarmowy. W przypadku wirusa SARS-CoV-2 receptorem błonowym na komórce gospodarza jest białko ACE2 (konwertaza angiotensyny II). Obecność receptorów ACE2 stwierdzono m.in. w górnych drogach oddechowych i na komórkach nabłonkowych ślinianek, które stanowią wczesne cele infekcji. Ich duże zagęszczenie występuje też w jamie ustnej, zwłaszcza w nabłonku języka i limfocytach śluzówki.
SARS-CoV-2 przenosi się drogą kropelkową; do zakażenia może dojść nie tylko przez kontakt bezpośredni z nosicielem, ale też przez kontakt pośredni ze skażonymi przedmiotami i powierzchniami.
Według badań prowadzonych na początku pandemii, SARS-CoV-2 może przetrwać do 72 godzin na powierzchni plastikowej lub ze stali nierdzewnej i 4 godziny na powierzchni miedzianej.
Higiena we wspólnej łazience, czyli jak uniknąć COVID-19?
Wyniki wcześniejszych badań wskazywały, że dokładne szczotkowanie zębów, higiena przestrzeni międzyzębowych i czyszczenie języka to podstawowe i niezbędne zabiegi w celu zmniejszenia wiremii w jamie ustnej. Na podstawie uzyskanych dowodów naukowcy odradzają ponadto przechowywanie szczoteczek do zębów we wspólnym pojemniku/kubku. Przybory higieniczne po użyciu ulegają zanieczyszczeniu i – jeśli nie zostaną zdezynfekowane – mogą zwiększać ryzyko transmisji zakażeń. Przeżywalność wirusa SARS-CoV-2 zwiększa ryzyko ponownego wprowadzenia (żywego) patogenu do jamy ustnej lub jego przeniesienia na współmieszkańców. Więcej
55 gram jogurtu dziennie – jak dowodzą badania naukowców, zaledwie tyle wystarczy, aby chronić nasze zęby przed paradontozą – groźną chorobą dziąseł, która może prowadzić do uszkodzenia, a nawet wypadania zębów. Dowiedzmy się, dlaczego jogurt ma pozytywny wpływ na zdrowie jamy ustnej i dlaczego podobnego wpływu nie wykazuje samo mleko.
Jogurt a paradontoza
Na korzyści płynące z regularnego spożywania jogurtu wskazują m.in. badania przeprowadzone przez japońskich naukowców na grupie 942 osób – kobiet oraz mężczyzn w wieku 40-79 lat. Wyniki badań doprowadziły do wniosków, że osoby, które spożywały dziennie 55 gram jogurtu bądź innego przetworu mlecznego, takiego jak kefir czy ser, miały mniej zaawansowane choroby dziąseł w porównaniu z osobami, których dieta pozbawiona była produktów mlecznych bogatych w probiotyki. Więcej
Praca lekarza stomatologa i pomocniczego personelu stomatologicznego związana jest z różnorodnymi obciążeniami zdrowotnymi, m.in. konsekwencjami oddziaływania metali ciężkich, zwłaszcza par rtęci. Wykazano, że rtęć może tygodniami lub miesiącami pozostawać w organizmie, przy czym jej szkodliwość zależy od formy chemicznej, ilości, drogi i czasu narażenia oraz od indywidulanej podatności.
Zawodowe narażenie na rtęć w stomatologii
Rtęć od niemal 200 lat jest składnikiem amalgamatu stomatologicznego, którego użycie, co prawda, zmniejsza się w krajach rozwiniętych, jednak w krajach rozwijających się wciąż utrzymuje na wysokich poziomach.
Rtęć stanowi (dokładnie ta sama, która znajdowała się w wycofanych już rtęciowych termometrach) ok. połowy całkowitej masy amalgamatu (pozostałe składniki: srebro, cyna, miedź, cynk, także kadm i in). W wyniku narażenia przez układ oddechowy rtęć z płuc przedostaje się do krwiobiegu, następnie do mózgu i nerek. Personel stomatologiczny narażony jest przede wszystkim na pary w czasie przygotowania, odbudowy i usuwania amalgamatu dentystycznego.
Trwałość wypełnień amalgamatowych jest zmienna, średnio wynosi ok. 10 lat. Po zakończeniu okresu użytkowania konieczne jest usunięcie amalgamatu – za pomocą wiertła stomatologicznego o dużej prędkości. Wyniki badań wskazują, że narażenie personelu na opary rtęci może utrzymywać się do godziny po zabiegu (z wykorzystaniem wiertarki o dużej prędkości).
Wykazano, że nadmierne zawodowe narażenie na pary rtęci metalicznej może powodować zmiany neurobehawioralne i uszkodzenie nerek. Rtęć wykazuje także działanie miażdżycorodnie i hipertensyjnie (które może być wtórne do jej działania nefrotoksycznego). Zaobserwowano ponadto, że rtęć może wywierać negatywny wpływ na czynność grasicy.
W ostatnich latach zwraca się uwagę na związek między narażeniem na rtęć a drżeniem mięśniowym. Rtęć jest także słabym czynnikiem alergizującym; kontakt z solami rtęci może przyczyniać się do nadwrażliwości i kontaktowego zapalenia skóry lub reakcji nadwrażliwości typu IV. Na typowe objawy alergii składają się: wysypka pokrzywkowa/rumieniowa, świąd (twarz, zgięcia kończyn) oraz progresja do zapalenia skóry. U stomatologów i personelu stomatologicznego stosunkowo rzadko występuje alergia na rtęć (częściej u kobiet). W diagnostyce stosuje się test immunostymulacji limfocytów pamięci MELISA i testy płatkowe skórne.
Od 2018 r. obowiązuje Rozporządzenie Parlamentu Europejskiego i Rady (UE) 2017/852[1], zgodnie z którym od 1.07.2018 r. nie można używać amalgamatu stomatologicznego w leczeniu zębów mlecznych, w leczeniu stomatologicznym dzieci w wieku poniżej 15 lat i kobiet w ciąży lub matek karmiących, z wyjątkiem sytuacji, które lekarz dentysta uzna za absolutnie niezbędne (ze względu na szczególne potrzeby medyczne pacjenta). Więcej
Jon glinu i fluorek wykazują zdolność tworzenia stabilnych kompleksów (Al-F). Stale podejmowane są próby badań interakcji między tymi jonami oraz związku powstałych kompleksów z fluorozą. Dowiedziono np., że glin – zaburzając absorpcję fluorku – wpływa na redukcję fluorozy u zwierząt, natomiast stosunkowo nieduże dawki wodorotlenku glinu u ludzi mogą istotnie zmniejszać ilość pobieranego fluorku, a zwiększać wydalanie.
Zainteresowanie badaczy kompleksami Al-F i ich związkami z zaburzeniami mineralizacji i fluorozą nieustannie rośnie.
Ciemne i jasne strony fluorków
Fluorki (F-) są absorbowane do naszego ustroju przede wszystkim przez przewód pokarmowy i płuca. Wchłanianie jest szybsze w środowisku o niskim pH. Spożywanie produktów zawierających m.in. związki glinu ogranicza absorpcję fluorków w przewodzie pokarmowym przez tworzenie trudno rozpuszczalnych soli. Jon fluorkowy z osocza krwi przenika do tkanek (kumuluje się w kościach) lub do nerek (jest wydalany).
Dzięki badaniom nad oddziaływaniem związków fluoru na nasze zdrowie udało się ustalić znamienną zależność między fluorkami a próchnicą zębów. Wykazano, że skuteczna profilaktyka próchnicy polega na miejscowym działaniu fluorków na szkliwo. Fluorki zaburzają proces demineralizacji, przyspieszają remineralizację i hamują procesy wytwarzania kwasów przez płytkę bakteryjną. Jednak nadmierna ekspozycja na fluorki (długotrwała, zbyt duże dawki) może wywierać niekorzystny wpływ na zdrowie człowieka (m.in. osłabiać układ immunologiczny i układ nerwowy, prowadzić do ospałości lub depresji). Skutkiem zbyt dużych dawek fluorków jest fluoroza – choroba ogólnoustrojowa powodująca uszkodzenie wątroby, nerek, zaburzenia wzroku. Jedną z jej charakterystycznych manifestacji jest cętkowane zabarwienie na zębach i wzrost ich kruchości. To konsekwencja uszkodzenia ameloblastów (komórek budujących szkliwo) przez nadmiar tego pierwiastka, a także jego hamującego wpływu na działanie enzymów, co utrudnia mineralizację szkliwa. Podejrzewa się, że w rozwoju fluorozy szkliwa biorą udział białka G ameloblastów (białka te mogą uczestniczyć w zaburzeniach drogi sekrecyjnej ameloblastów we fluorozie szkliwa). Skutkiem mogą być także niekorzystne zmiany w układzie kostnym. W wyniku pogrubienia w kościach warstwy koronowej dochodzi do skrzywień i deformacji kręgosłupa. Odkładanie związków fluoru w kościach różni się zależnie od wieku – największą kumulację potwierdzono u dzieci (ponad 50%) i młodzieży (50%), znacznie niższa jest u seniorów (ok. 10%). Więcej
Seniorzy, czyli osoby po 60. roku życia, wskutek upływu czasu zmagają się z wieloma problemami zdrowotnymi, także tymi, które dotyczą jamy ustnej. Kserostomia, czyli suchość w jamie ustnej, jest jednym z najczęściej pojawiających się kłopotów zdrowotnych u osób starszych. Za najczęstszą jej przyczynę w tej grupie wiekowej uznaje się zażywanie leków.
Suchość w jamie ustnej wynika ze zmniejszonego lub zahamowanego wydzielania śliny, a także ze zmiany stopnia uwodnienia śliny. Poza lekami nieprawidłowości w wydzielaniu śliny mogą powodować również choroby ślinianek bądź uszkodzenia gruczołów ślinowych, powstałe na przykład w wyniku radioterapii. Więcej na temat kserostomii pisaliśmy w tym artykule.
Leki powodujące suchość w jamie ustnej
Z badań wynika, że leki potencjalnie kserogenne, czyli powodujące suchość w jamie ustnej, to głównie diuretyki, psychotropy, leki sercowo-naczyniowe, a także leki przeciwbólowe i przeciwhistaminowe. Ponieważ seniorzy zmagają się z wieloma chorobami wynikającymi z wieku, często też zażywają wiele różnych leków. Mówi się tutaj o zjawisku polifarmacji – kiedy chory zażywa 5-9 leków – i hiperpolifarmacji, gdy przyjmuje codziennie ponad 10 leków. Z badania, które zostało przeprowadzone przez naukowców z niemieckiego University Medicine Greifswald, wynika, że więcej leków, które potencjalnie mogą powodować suchość w jamie ustnej, zażywają mężczyźni niż kobiety. Panowie przyjmowali też więcej od kobiet leków na choroby sercowo-naczyniowe, z kolei kobiety częściej były narażone na powstanie suchości w jamie ustnej z powodu przyjmowania większej niż mężczyźni liczby leków wpływających na układ nerwowy. Więcej
Nie tylko kaszel, gorączka, duszności i ból mięśni – również zaburzenia węchu i smaku należą do głównych objawów COVID-19. Okazuje się, że – równie często jak utrata węchu i smaku – chorym doskwiera kserostomia, czyli uczucie suchości w ustach.
Badanie przeprowadzone przez włoskich naukowców i opublikowane niedawno w American Journal of Otolaryngology miało na celu ocenę częstości występowania i scharakteryzowanie konkretnych objawów związanych z COVID-19, takich jak kserostomia – uczucie suchości w ustach, zaburzenia smaku i zaburzenia węchu.
Ślina – niedoceniana bariera ochronna
U dorosłego człowieka w ciągu doby produkowane jest ok. 0,5–1 litra śliny, większość w ciągu dnia (w nocy produkowane jest jedynie kilka procent objętości dobowej). Za jedną z podstawowych funkcji śliny – utrzymanie integralności tkanek jamy ustnej – odpowiada ślina „spoczynkowa” czyli niestymulowana, wydzielana przez duże i małe gruczoły ślinowe, umiejscowione we wszystkich częściach błony śluzowej jamy ustnej (oprócz dziąseł i przedniej części podniebienia twardego). Funkcje trawienne pełni ślina wydzielana po stymulacji – po przyjęciu pożywienia (ślina stymulowana stanowi 80% całej objętości śliny). Właściwym środowiskiem jamy ustnej jest jednak ślina mieszana (całkowita): mieszanina wydzielin 6 dużych i 200–400 małych gruczołów ślinowych oraz wielu innych elementów (np. złuszczonych komórek nabłonka, leukocytów, bakterii, wirusowy, resztek pokarmowych, płynu dziąsłowego i in.). Więcej
Próbki śliny mogą być bardzo dobrym nieinwazyjnym biomarkerem chorób jelit – orzekli naukowcy z uniwersytetów w Tokio po dokonaniu przeglądu wielu prac naukowych, których tematyka skupia się na powiązaniach pomiędzy mikroflorą jamy ustnej a jelit. Badanie śliny mogłoby być szczególnie przydatne w diagnozowaniu nieswoistego zapalenia jelit.
Nieswoiste zapalenie jelit jest schorzeniem, które daje również objawy w jamie ustnej. Na razie diagnozowane jest poprzez badanie próbek krwi, stolca i z wykorzystaniem inwazyjnych technik obrazowania diagnostycznego. Tymczasem – prawdopodobnie – mamy do dyspozycji dużo bardziej proste i nieinwazyjne rozwiązanie – próbki śliny. Test ze śliny można byłoby łatwo wykonać podczas rutynowego przeglądu stomatologicznego. Choćby po to, aby dowiedzieć się, czy symptomy obserwowane w jamie ustnej mogą mieć źródło w jelitach.
Bakteryjna oś: jama ustna – jelita
W ostatnich latach pojawiło się wiele dowodów na to, że istnieje silne powiązanie pomiędzy mikrobiomem jamy ustnej i jelit – mówi się nawet o osi jama ustna – jelita. Poza tym, zarówno bakterie w jamie ustnej, jak drobnoustroje, które znajdują się w jelitach, stanowią fundament utrzymania homeostazy w organizmie. Choć skład mikrobiologiczny śliny u człowieka nie odzwierciedla całkowicie składu ludzkiego mikrobiomu jelitowego, to niektóre badania sugerują, że zmiana profilu mikrobiologicznego śliny może być skutkiem zmiany profilu mikrobiomu zasiedlającego jelita. Szczególnie dobrze zależność tę widać podczas suplementacji probiotykami. W oparciu o te doniesienia wspomniani badacze z Japonii doszli do wniosku, że badanie próbek śliny mogłoby posłużyć jako nieinwazyjny test chorób jelit, w tym nieswoistego zapalenia jelit. Więcej
Pasty do zębów – wszystko, co należy o nich wiedzieć
Pasta do zębów to obok szczoteczki do zębów podstawowy produkt do codziennej higieny jamy ustnej. Wciąż jednak wiele osób nie zdaje sobie sprawy, że pasta do zębów odgrywa ważną rolę nie tylko w zachowaniu zdrowia uzębienia i innych tkanek jamy ustnej, ale także chroni zdrowie całego organizmu. Zdrowie zaczyna się w jamie ustnej, a zaniedbania w higienie lub używanie niewłaściwie dobranych produktów do utrzymania czystości tego obszaru organizmu mogą doprowadzić do powstania wielu szkód w ustroju. Choć wydaje się nieprawdopodobne, aby właściwy dobór pasty do zębów mógł mieć ogromny wpływ na zdrowie ogólne, tak właśnie jest – bo pasty do zębów cechują się ściśle określonymi właściwościami. Z tego powodu produkty te należy dobierać do indywidualnych potrzeb. Oferta past jest bardzo bogata, ale aby dobrze wybrać, trzeba wiedzieć, czego potrzebują nasze zęby i inne tkanki jamy ustnej.
Jaką pastę do zębów wybrać?
Zapoznaj się z naszym kompendium wiedzy na temat past do zębów – dzięki temu dowiesz się, która pasta będzie najlepsza dla Ciebie.
JAKĄ POSTAĆ MOŻE MIEĆ PASTA DO ZĘBÓW?
Pasta do zębów najczęściej ma postać mieszaniny o konsystencji papki, kremu lub gęstej śmietany. Istnieją też pasty do zębów w formie żelu (np. Tołpa Expert Parodontosis), dość często taką właśnie formę przyjmują produkty dla dzieci (np. Ziaja Ziajka lub Ziaja Maziajki) lub produkty przeznaczone do remineralizacji zębów (np. Elmex Gel, Miradent zMirafluor Gel). Na rynku dostępne są też produkty w niczym nie przypominające pasty w tradycyjnej postaci, ale rekomendowane jako działające analogicznie do tego preparatu i przeznaczone do codziennego stosowania: Więcej
Próchnica zębów to współcześnie najbardziej rozpowszechniona zakaźna choroba cywilizacyjna. Jest schorzeniem wieloprzyczynowym, które spowodowane jest wzajemnym oddziaływaniem czynników z wielu obszarów: środowiska, genów, zachowań. Owo współoddziaływanie dotyczy czterech podstawowych elementów: gospodarza, substratu, bakterii, czasu. I każdy z wymienionych elementów ma swój udział w budowaniu odporności na próchnicę – choć u konkretnej osoby każdy z tych czynników będzie się cechował różną siłą wpływu.
Wieloczynnikowa odporność na próchnicę
Odporność na próchnicę warunkowana jest przez następujące elementy:
- Osobnicze właściwości zębów i szkliwa – wynikają z predyspozycji genetycznych konkretnej osoby i jej wieku[1]. Pewne choroby genetyczne mają lub mogą mieć wpływ na odporność zębów na próchnicę, ponieważ skorelowane są z występowaniem np. niedorozwoju szkliwa czy wad zgryzu. Udowodniono też, że na dobrą odporność szkliwa wpływa odpowiednie ułożenie hydroksyapatytów w krystalicznej siatce minerałów tworzących tę tkankę[2]. Uformowanie powierzchni żujących zębów także może silnie kształtować odporność na próchnicę – powierzchnię, którą charakteryzują bruzdy szerokie i płytkie, łatwiej i skuteczniej oczyszcza się z zalegającego na niej osadu niż tę z bruzdami głębokimi, z których trudniej usunąć nalot nazębny.
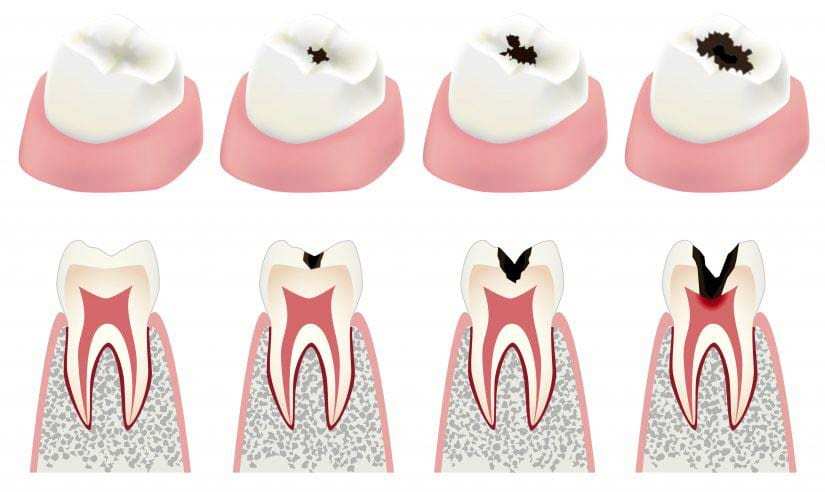 etapy próchnicy – wcześnie wykryta może uniknąć leczenia kanałowego
etapy próchnicy – wcześnie wykryta może uniknąć leczenia kanałowego
Paradontoza i inne postaci przewlekłego zapalenia przyzębia przez długie lata uznawano głównie za choroby związane z wiekiem. Kolejne badania naukowe potwierdzały jednak, że za destrukcję tkanek utrzymujących zęby w karnym łuku i w kości szczęk odpowiedzialne są bardziej drobnoustroje niż liczba przeżytych lat. Jednym z mikroorganizmów izolowanych z patologicznych kieszonek dziąsłowych była bakteria Porphyromonas gingivalis. Ta niewielka Gram ujemna pałeczka, którą po raz pierwszy opisano w 1921 roku, wygląda niepozornie. Rosnąc na pożywkach w warunkach laboratoryjnych, może tworzyć zielonkawe, interesujące pod względem kształtu kolonie. Na początku XXI wieku uznawana była już za jeden z gatunków silnie powiązanych z chorobami dziąseł i przyzębia.1 Obecnie wiadomo, że to wróg numer 1 zdrowia tkanek przyzębia. Jej siła działania ukrywa się między innymi w wytwarzanych przez nią gingipainach. To enzymy, dzięki którym bakteria nie tylko pozyskuje dostęp do potrzebnych jej składników odżywczych. Ułatwiają one również przyczepianie się P. gingivalis do tkanek i – co najistotniejsze – potrafią modulować działanie układu immunologicznego gospodarza, kierując jego ataki na swoje własne tkanki a nie na niszczące przyzębie patogeny. Warto podkreślić, że im bardziej zaawansowana destrukcja tkanek przyzębia, tym większy udział populacji P. gingivalis w całej puli mikroorganizmów patogennych izolowanych z chorych obszarów.
W badania nad P. gingivalis już od wielu lat mocno angażuje się prof. Jan Potempa, biochemik i mikrobiolog. Za swoją pracę w tym obszarze odebrał w 2011 r. nagrodę Fundacji na rzecz Nauki Polskiej zwaną polskim Noblem.
Porphyromonas gingivalis – niszcząca moc o wymiarach mikro
Bakteria P. gingivalis uznawana jest za najbardziej wirulentny i patogenny drobnoustrój w swojej grupie, a coraz więcej wyników badań potwierdza jej negatywny wpływ nie tylko na zdrowie tkanek przyzębia, ale również na zdrowie ogólne. Zjadliwość i skuteczność tego gatunku bakterii zapewniają:
- Gingipainy – gatunek wytwarza dwie różne klasy tych enzymów. Ich rolą jest:
- Wspomaganie pozyskiwania składników pokarmowych. Z enzymatycznego rozkładu dużych peptydów znajdujących się w osoczu krwi człowieka komórki gingivalis uzyskują pokaźne ilości azotu i węgla, a z rozkładu transferyny – wystarczającą ilość żelaza, które jest niezbędne do zapewnienia aktywności określonych szlaków metabolicznych w komórkach tych patogenów.2
- Wspomaganie inwazji i kolonizacji ciała gospodarza, czyli związanych z tym sił kohezji i adhezji. Dzięki tym siłom komórki bakteryjne mogą przyczepiać się do tkanek, a jednocześnie ściśle przylegać do siebie, co korzystnie wpływa na tworzenie, dojrzewanie i utrzymywanie struktury biofilmu.
- Osłabianie i modulowanie odpowiedzi immunologicznej gospodarza. Gingipainy działają tu na różne sposoby, m.in. modulują aktywność przeciwciał klasy IgG oraz cytokin prozapalnych, hamują dojrzewanie limfocytów T, a także zakłócają komunikację między komórkami i macierzą oraz hamują namnażanie się komórek odpornościowych.
- Niszczenie metaloprotein, kolagenu i fibronektyn, przez co komunikacja na linii komórki – macierz pozakomórkowa jest utrudniona lub blokowana.3 Tym samym gingipainy utrudniają wytwarzanie i transport czynników uczestniczących w zwalczaniu stanów zapalnych i biorących udział w regeneracji tkanek. Skutkiem tego jest postępująca degradacja tkanek przyzębia.
- Polisacharydowa kapsuła – warunkuje większą zjadliwość bakterii oraz zapobiega wchłonięciu patogenów przez fagocytujące komórki układu immunologicznego.
- Fimbrie – te niewielkie wypustki mają kluczowe znaczenie dla adhezji i kohezji komórek bakteryjnych oraz dla zapewnienia właściwej struktury biofilmu. Są też niezbędne do kolonizacji środowiska. Fimbrie długie odpowiadają za przyczepienie się bakterii do podłoża i za organizację biofilmu w pierwszych etapach jego powstawania. Z kolei fimbrie krótkie odgrywają istotną rolę w agregowaniu komórek i tworzeniu mikrokolonii oraz wielogatunkowych zespołów złożonych z różnych mikroorganizmów zasiedlających jamę ustną. Fimbrie wchodzą także w interakcje z białkami osocza oraz z receptorami chemokin, przez co – równolegle do gingipain – modulują odpowiedź immunologiczną gospodarza.
- Zwiększanie wirulencji innych patogennych gatunków bakterii zamieszkujących jamę ustną – gingivalis potrafią tworzyć zespoły z innymi bakteryjnymi patogenami żyjącymi w jamie ustnej i modyfikować ich funkcjonowanie tak, że te skuteczniej radzą sobie z niszczeniem tkanek przyzębia.
Skutki działania P. gingivalis
Gatunek P. gingivalis żyje głównie w nazębnej płytce poddziąsłowej (najczęściej wykrywa się go u osób z ciężkimi postaciami przewlekłych zapaleń przyzębia), ale także w ślinie, na śluzówce jamy ustnej, języku i migdałkach. Migdałki uznaje się za rezerwuar tego drobnoustroju. Poza jamą ustną bakteria ta znajdowana jest sporadycznie, ale może ona infekować narządy leżące daleko od tego obszaru ciała. Do takiej sytuacji dojdzie, kiedy P. gingivalis przedostanie się do krwiobiegu i wraz z krwią dotrze np. do nerek. Może tam wytworzyć wtórne ogniska zakażenia. P. gingivalis może zatem działać lokalnie – niszcząc tkanki przyzębia, ale też ogólnoustrojowo – co potwierdzają liczne doniesienia naukowe.
Szkodliwa skuteczność P. gingivalis wynika z dużej zdolności do przyczepiania się bakterii do nabłonka jamy ustnej oraz z aktywowania komórek – już nie tylko nabłonka, ale również śródbłonka, czyli warstwy wyściełającej naczynia.4 To dlatego bakteria jest tak skuteczna nie tylko w niszczeniu przyzębia, ale również w degradacji tkanki naczyniowej.
Najnowsze odkrycia naukowe potwierdzają związki P. gingivalis z następującymi zaburzeniami zdrowia:
- Choroby układu sercowo-naczyniowego – m.in. miażdżyca i choroba wieńcowa.
- Choroby układu oddechowego – m.in. zapalenie płuc.
- Choroby układu nerwowego – m.in. stwardnienie rozsiane.
- Zaburzenia przebiegu ciąży – m.in. przedwczesny poród, niska masa ciała noworodków.
- Choroby układu ruchu i autoimmunologiczne – m.in. reumatoidalne zapalenie stawów (RZS).
- Schorzenia onkologiczne – m.in. nowotwór trzustki.
wiesz, że...
dentysta.eu
- Ostatni dzwonek, aby tanio wymienić plomby amalgamatowe na lepsze i zdrowsze
- Co pacjenci sądzą o dentystach i jak (nie)wiele na ten temat wiedzą stomatolodzy
- Zapowiedź wyników badania – czego oczekują pacjenci i co dentyści wiedzą o pacjentach
- Pacjenci – widma prześwietleni: wyniki ankiety o umawianiu wizyt
- Wyniki ankiety „Uśmiech a status społeczny”
forum
u nas!
 Wysoka odwiedzalność serwisu sprawia że bez problemu dotrzesz do swoich nowych klientów!
Wysoka odwiedzalność serwisu sprawia że bez problemu dotrzesz do swoich nowych klientów!
 Wystarczy że dodasz swój gabinet w ogłoszeniach portalu - szybko i zupełnie za darmo!
Wystarczy że dodasz swój gabinet w ogłoszeniach portalu - szybko i zupełnie za darmo!
 Dzięki promowaniu zyskają również Twoi klienci którzy łatwo Cię odnajdą!
Dzięki promowaniu zyskają również Twoi klienci którzy łatwo Cię odnajdą!
 Nadal się wahasz? Kliknij:
Dowiedz się więcej
Rozwiń
Nadal się wahasz? Kliknij:
Dowiedz się więcej
Rozwiń